Recherche étudiant·es ou stagiaires
Expertises
Les interférons et l’immunité muqueuse , Cellules T , Cryptosporidium , Étude des interactions hôte-agent pathogène , Interférons
- Professeur régulier
Centre Armand-Frappier Santé Biotechnologie
531, boulevard des Prairies
Laval (Québec) H7V 1B7
Intérêts de recherche
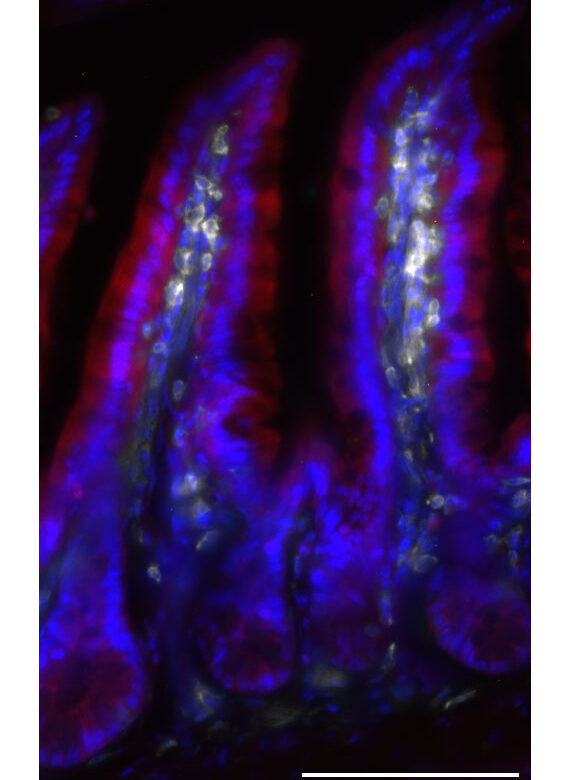
Cryptosporidium spp. sont des parasites du phylum Apicomplexa qui infectent les cellules épithéliales intestinales (CEI) et sont une cause majeure de maladie diarrhéique (la cryptosporidiose). En 2013, le “Global Enterics Multicenter Study” (GEMS) a identifié que Cryptosporidium est deuxième après rotavirus comme cause de la diarrhée sévère et mortalité pendant l’enfance en Afrique subsaharienne et en Asie du Sud. Les symptômes durent entre 1 à 2 semaines pour les individus immunocompétents; mais pour les individus avec les réponses des cellules T supprimées (ex. les receveurs des dons d’organes ou des patients avec le syndrome d’immunodéficience acquise [SIDA]) l’infection chronique peut se propager aux voies biliaires et au foie et peut devenir mortelle. En plus, le médicament pour traiter la cryptosporidiose, le Nitazoxanide, n’est pas approuvée pour usage au Canada et n’est pas efficace pour les individus immunodéficients, qui souligne le besoin de mieux comprendre le contrôle de Cryptosporidium par le système immunitaire.
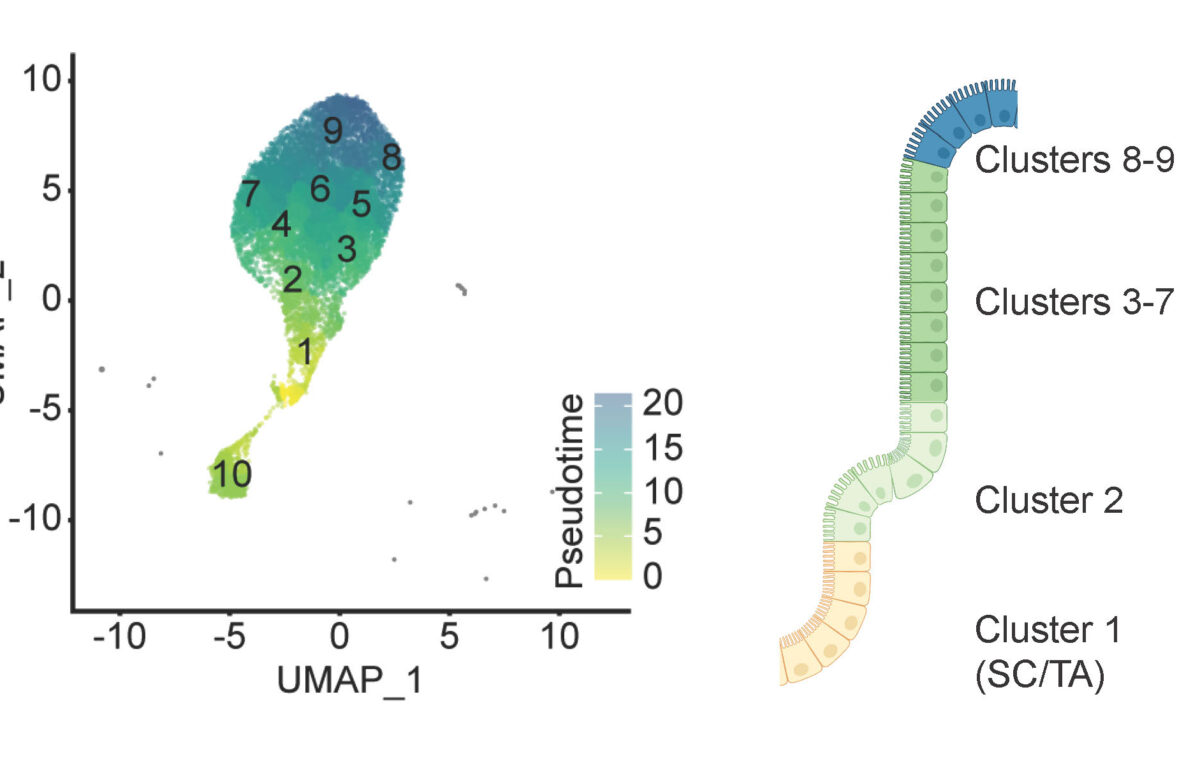
Les études précédentes ont identifié le rôle crucial de l’interféron-gamma (IFN-γ) dans le contrôle de la propagation du parasite et les cellules T dans l’élimination du parasite. Mes études récentes ont utilisé le séquençage d’ARN des cellules individuelles, la microscopie et la cytométrie en flux pour mieux comprendre les effets de l’IFN-γ et infection par Cryptosporidium sur les CEI et les dynamiques de contrôle du parasite après la stimulation avec l’IFN-γ. En particulier, nous avons démontré que l’IFN-γ signale sur les CEI non infectées pour limiter la propagation du parasite, en part parce que les CEI répondent lentement à l’IFN-γ en comparaison avec les cellules immunes.
Les recherches de mon laboratoire vont combiner ces techniques avec les organoïdes intestinales, les cultures en 3-dimensions qui imitent l’état naturel des CEI pour permettre les études avec les CEI primaires. Nous utiliserons ces outils pour étudier les interactions entre les interférons du type I, II, et III pendant l’infection par Cryptosporidium et comment ces signaux sont régulés par les CEI.
Projets d’études ou stages offerts
Professeur Ryan Pardy a reçu son BScH dans le département des sciences biomédicales et moléculaires de l’Université Queen’s (Kingston, Canada) en 2015. Il a obtenu son doctorat à l’université McGill (Montréal, Canada) en 2020 dans le laboratoire de Prof. Martin Richer, où il étudiait les réponses par les cellules T à l’infection avec le virus Zika et a identifié comment les isolats épidémiques du virus Zika étaient capable d’éviter la réponse immunitaire de l’hôte en contournant la présentation des antigènes. Les recherches postdoctorales de Prof. Pardy prenait place dans les laboratoires de Prof. Chris Hunter et Prof. Boris Striepen à l’université de Pennsylvania (Philadelphia, É-U) où il étudiait comment les cellules épithéliales intestinales répondent à l’interféron-gamma dans le contexte d’infection avec les parasites Cryptosporidium. Prof. Pardy s’est joint au corps professoral du Centre Armand-Frappier Santé Biotechnologie de l’INRS en mai 2024, où son laboratoire poursuivra les recherches pour mieux comprendre comment les cellules épithéliales intestinales régulent leur capacité à répondre aux interférons et l’initiation des mécanismes de défense intracellulaires par ces cytokines.
Publications
Publications sélectionnées
Pardy RD, Walzer KA, Wallbank BA, Byerly JH, O’Dea KM, Cohn IS, Haskins BE, Roncaioli JL, Smith EJ, Buenconsejo GY, Striepen B and CA Hunter. 2024. Analysis of intestinal epithelial cell responses to Cryptosporidium highlights the temporal effects of IFN-γ on parasite restriction. PLOS Pathogens 20(5): e1011820.
Pardy RD*, Wallbank BA*, Striepen B and CA Hunter. 2023. Immunity to Cryptosporidium: insights into principles of enteric immune responses. Nature Reviews Immunology 24(2): 142-55.
* These authors contributed equally to this work
Haskins BE, Gullicksrud JA, Wallbank BA, Dumaine JE, Guerin A, Cohn IS, O’Dea KM, Pardy RD, Merolle MI, Shallberg LA, Hunter EN, Byerly JH, Smith EJ, Buenconsejo GY, McLeod BI, Christian DA, Striepen B and CA Hunter. 2024. Dendritic cell-mediated responses to secreted Cryptosporidium effectors are required for parasite-specific CD8 (+) T cell responses. In Press, Mucosal Immunology.
Gibson AR, Sateriale A, Dumaine JE, Engiles JB, Pardy R, Gullicksrud JA, O’Dea K, Doench JG, Beiting DP, Hunter CA and B Striepen. 2022. A genetic screen identifies a protective type III interferon response to Cryptosporidium that requires TLR3 dependent recognition. PLOS Pathogens 18(5): e1010003.
Pardy RD, Gentile ME, King IL and MJ Richer. 2022. An Epidemic Zika Virus Isolate Drives Enhanced T Follicular Helper Cell and B Cell-Mediated Immunity. Journal of Immunology 208(7):1719-1728.
Pardy RD, Valbon SF, Cordeiro B, Krawczyk CM and MJ Richer. 2021. An Epidemic Zika Virus Isolate Suppresses Antiviral Immunity by Disrupting Antigen Presentation Pathways. Nature Communications 12(1): 4051.