- Recherche
-
VOUS ÊTES
- Membre de la communauté
- Futur étudiant
- Étudiant
- Professeur
- Diplômé
- Média
- Conseillers en orientation
- Retraité de l’INRS
- Nous joindre
- Nouvelles
- Emplois
- EN
-
Les Études
Nous formons la relève en recherche, capable d'innovation scientifique, sociale et technologique.
-
La recherche
Nous trouvons des solutions par la recherche interdisciplinaire, en collaboration avec nos partenaires.
-
L'INRS
Nous contribuons au développement économique, social et culturel du Québec.
Des chercheurs de l’Institut national de la recherche scientifique (INRS) ont démontré que des nanoparticules permettraient la livraison de médicaments au cerveau pour le traitement de maladies neurodégénératives.
La barrière entre le sang et le cerveau représente le principal obstacle dans le traitement de maladies comme l’Alzheimer et le Parkinson. Selon une étude récente, menée par Jean-Michel Rabanel, chercheur postdoctoral dirigé par le professeur Charles Ramassamy, des nanoparticules avec certaines propriétés spécifiques pourraient traverser cette barrière et être captées par les cellules neuronales. Les chercheurs sont convaincus que ces résultats ouvriront des perspectives importantes pour libérer des médicaments directement au cerveau. Cette avancée permettrait d’améliorer le traitement de maladies neurodégénératives touchant plus de 565 000 Canadiens, dont 141 000 Québécois.

« La barrière sang-cerveau filtre les substances nocives pour qu’elles ne puissent pas se rendre librement au cerveau. Or, cette même barrière empêche aussi le passage des médicaments », explique le pharmacologue Charles Ramassamy. Généralement, les doses administrées doivent être élevées pour qu’une petite fraction du médicament atteigne le cerveau, et ce qui reste en circulation dans le sang induit des effets secondaires importants. Cet inconfort pousse souvent le patient à arrêter le traitement. L’utilisation de nanoparticules qui encapsulent les médicaments entraînerait moins d’effets secondaires périphériques tout en augmentant l’efficacité cérébrale.
Efficace dans un modèle animal
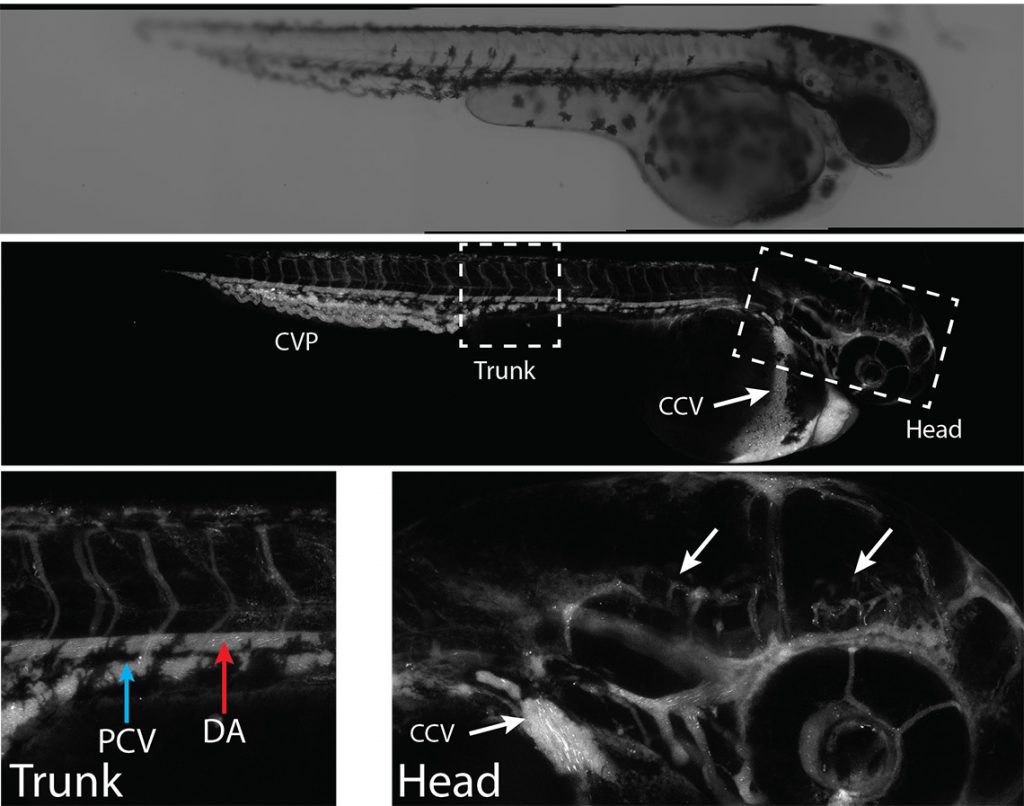
Pour prouver l’efficacité de cette méthode, l’équipe de recherche l’a d’abord testée sur des cellules en culture, puis chez le poisson-zèbre. « Cette espèce offre plusieurs avantages. Sa barrière sang-cerveau se rapproche de celle de l’humain, et son corps transparent permet de voir la distribution des nanoparticules presque en temps réel », indique le professeur Ramassamy, aussi titulaire de la Chaire de recherche Louise et André Charron sur la maladie d’Alzheimer de la Fondation Armand-Frappier.
Avec ces tests in vivo, les chercheurs ont pu observer le passage à travers la barrière sang-cerveau. Ils ont aussi confirmé l’absence de toxicité des nanoparticules choisies. « Nous avons fabriqué les particules avec de l’acide polylactique (PLA), un matériau biocompatible facilement éliminé par l’organisme. Une couche de polyéthylène glycol (PEG) recouvre les nanoparticules et les rend invisibles au système immunitaire afin qu’elles puissent circuler dans le sang plus longtemps », explique-t-il.
Après plusieurs années de recherche sur les nanoparticules efficaces et sécuritaires, l’équipe de chercheurs poursuivra les tests en laboratoire, en ciblant l’administration de principes actifs sur d’autres modèles animaux avec, ultimement, des applications en clinique.
À propos de l’étude
L’article « Transport of PEGylated-PLA nanoparticles across a blood brain barrier model, entry into neuronal cells and in vivo brain bioavailability » a été publié en septembre 2020 dans la prestigieuse revue Journal of Controlled Release. Les chercheurs ont reçu un soutien financier du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG), du Fonds de recherche du Québec – Nature et technologies (FRQNT), du Fonds de recherche du Québec – Santé (FRQS), de la Fondation canadienne pour l’innovation (FCI) et de la Fondation Armand-Frappier (Chaire de recherche Louise et André Charron sur la maladie d’Alzheimer). https://doi.org/10.1016/j.jconrel.2020.09.042
Vous aimerez aussi

9 novembre 2020
Projet de doctorat en virologie moléculaire, relation virus-hôte
9 novembre 2020
Márta RadóPartager

