- Recherche
Le professeur Nicolas Doucet de l’INRS nous raconte comment la structure d’une protéine du coronavirus, la protéine S, le rend capable d’infecter les cellules de notre corps.
Le texte de vulgarisation du professeur Nicolas Doucet « Un voyage rapide dans l’infiniment petit : comment une poignée d’atomes est responsable de l’infection au coronavirus » est tiré du site Web de son laboratoire.
Un voyage rapide dans l’infiniment petit : comment une poignée d’atomes est responsable de l’infection au coronavirus

J’ai toujours trouvé comique qu’on me parle d’alimentation lorsque je mentionne aux gens que je travaille en ingénierie des protéines. Les protéines, c’est pourtant la base de tout ce qui est vivant ! Des bactéries aux cellules humaines, en passant par les plantes et les levures, toute la vie est construite à partir de protéines. Non seulement elles sont impliquées dans l’architecture moléculaire de toutes nos cellules, mais elles se chargent également d’effectuer pratiquement toutes les réactions chimiques de la vie. Bref, les protéines, ce n’est pas qu’une question d’alimentation !
À cet effet, saviez-vous que ce qui est littéralement et figurativement en train de détruire nos vies ces jours-ci est pas mal la faute… d’une protéine ? En effet, il s’agit de la protéine « spike » du coronavirus (ou protéine S, pour les intimes). Je vous invite à me suivre dans cette illustration, qui vous donnera une petite idée du type de recherche que nous effectuons dans notre laboratoire au quotidien : de la biologie structurale, l’une des nombreuses disciplines de la biochimie. Suivez-moi.
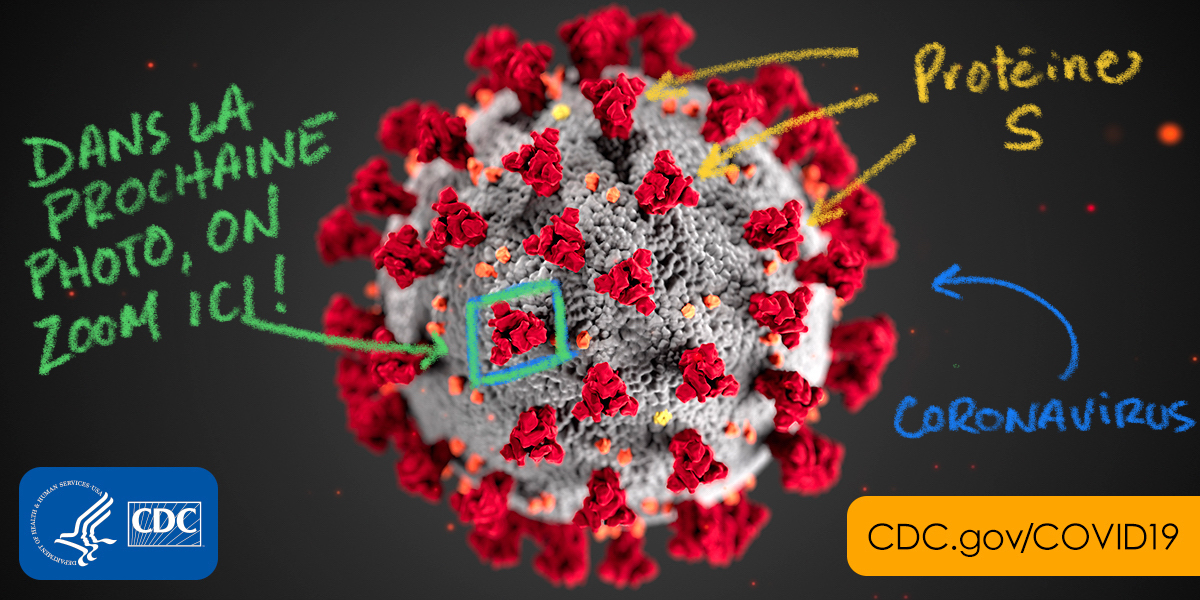
Vous savez quand les médias vous montrent une représentation schématique du coronavirus durant les bulletins de nouvelles ? Cette grosse boule avec des petits points un peu partout en surface (en rouge sur la photo ci-après) ?
Ces petits points rouges (qui ne sont pas vraiment rouges, on s’entend), il s’agit en fait de la fameuse protéine S du coronavirus. Cette protéine est le point d’entrée du virus dans les cellules de notre corps, la seule manière que cette petite bête inanimée possède pour nous infecter. Autrement dit, la protéine S est un peu comme une clé qui permet de reconnaître une serrure qui se situe à la surface de nos cellules. (Cette serrure, c’est une autre protéine appelée ACE2, mais je vous épargne les détails.)
Sans la reconnaissance exacte et spécifique entre la clé du virus et la serrure sur nos cellules, le coronavirus ne peut pas nous infecter. Niet, nada, no, nein, ça ne fonctionne pas ! Or, sachant que notre environnement quotidien est littéralement composé de milliards de virus, il est plutôt surprenant que des infections virales comme celle qui nous afflige à l’heure actuelle ne se produisent pas plus souvent. D’ailleurs, mon collègue Sylvain Moineau de l’Université Laval utilise une belle analogie à cet effet : si vous allez près d’un lac et que vous prenez de l’eau entre vos deux mains, vous tenez à ce moment précis peut-être plus de virus dans vos mains qu’il y a d’humains sur la planète ! Impressionnant, n’est-ce pas ?
Or, la très grande majorité de tous ces virus est totalement inoffensive pour nous, car ils s’attaquent principalement aux bactéries. D’autres virus, par contre, peuvent s’attaquer aux animaux et aux humains, à condition qu’ils aient la *bonne* clé avec la *bonne* serrure. Sans cette combinaison précise, vous poursuivez votre petit bonhomme de chemin comme si de rien n’était. En revanche, avoir la bonne combinaison clé-serrure, c’est assez rare puisque ça dépend d’une organisation extrêmement précise de certains atomes au bon endroit et au bon moment.
Pour permettre au coronavirus d’infecter les humains, la protéine S doit donc pouvoir reconnaître et communiquer au niveau atomique de manière extrêmement précise avec la serrure humaine. La beauté, c’est que plusieurs avancées scientifiques des 50-75 dernières années nous permettent aujourd’hui de « voir » ces interactions au niveau atomique. Grosso modo, grâce aux nouvelles technologies financées par des investissements en recherche fondamentale, on a développé des outils pour visualiser un objet moléculaire à l’échelle atomique, qu’il s’agisse d’une protéine, une cellule, d’un virus, etc.
C’est complexe à réaliser et je vous épargne les détails, mais c’est justement ce qu’on appelle la biologie structurale, ou l’art de visualiser l’organisation 3D des molécules de la vie lorsqu’elles effectuent toutes les réactions chimiques qui nous maintiennent en vie, dans l’infiniment petit. Parce que c’est bel et bien ce que nous sommes tous : des milliards de réactions chimiques organisées et coordonnées en temps réel dans chacune de nos cellules et à chaque seconde de notre vie (et même après notre mort).
Bon, c’est bien beau tout ça, mais à quoi ça sert de voir ces molécules en 3D ? J’en reviens à notre coronavirus. Nous avons beaucoup de chance, car deux groupes de recherche ont déjà réussi à prendre une « photo » de la structure 3D de la protéine S située à la surface du coronavirus, en plus de la « photo » de la protéine S lorsqu’elle reconnaît sa serrure à la surface de nos cellules. En utilisant des avancées technologiques modernes qui n’existaient pas jusqu’à récemment, ces chercheurs ont réussi cet exploit en un temps record d’à peine 2-3 mois et ont publié leurs résultats dans la prestigieuse revue Science (voir les références ci-après).
À titre comparatif, et pour vous donner une idée de l’avacement technique fulgurant accompli ces dernières années, certains détails moléculaires équivalents ont pris plus de 20 ans à être réalisés avec autant de précision pour le VIH ! Réussir cela en moins de 2-3 mois demeure donc un exploit colossal, qui n’est rendu possible que par les avancées technologiques récentes et les investissements en science fondamentale.
Sachant tout cela, je m’amuse ici à vous montrer quelques clichés atomiques de la protéine S du coronavirus. Ces images ont été préparées à partir des données atomiques de ces chercheurs, dont les résultats sont disponibles publiquement, car ils ont été financés par les gouvernements et nos taxes (comme la très grande majorité de la recherche fondamentale, d’ailleurs). En regardant la protéine S au niveau moléculaire, on peut prendre une « photo » de tous les atomes qui la composent. Lorsque schématisée, elle a donc a l’air de ça :

Vite comme ça, avouez que ça a l’air de gros barbouillis en forme de rubans dessinés au crayon par mes deux filles, n’est-ce pas ? Mais non, je vous assure : c’est hyper bien organisé au niveau moléculaire et ça se tient en bloc à l’aide de dizaines de milliers d’interactions atomiques qui se reconnaissent entre elles de manière très spécifique. Et ça bouge ! Le monde de l’infiniment petit est un univers absolument fascinant en soi, qui obéit à des règles bien précises. Et avec les bonnes techniques et les bonnes « caméras », on peut à peu près prendre des photos et regarder ce qui se passe au niveau atomique chez les protéines, même si tout ça est totalement invisible à l’œil nu.
Bref, en regardant la photo précédente, vous voyez cette petite section coloriée en vert avec des mini points rouges dessus ? On appelle cette section de la protéine S le « receptor binding domain » (ou RBD, pour les intimes). Comme son nom l’indique, il s’agit de la seule section de la grosse protéine S du coronavirus qui contacte la serrure à la surface de nos cellules. Et les petits points rouges au bout du RBD, ce sont les seuls atomes qui sont absolument essentiels pour établir ce contact.
C’est un peu comme la main de votre corps qui prend la poignée d’une voiture : votre corps au complet est essentiel pour vous déplacer vers la voiture, mais c’est uniquement votre main qui agrippe et tire la poignée pour l’ouvrir. Le virus fait pareil avec la protéine S (son corps), alors que le RBD tire la poignée. Et voici ce que ça a l’air quand on regarde encore plus près :
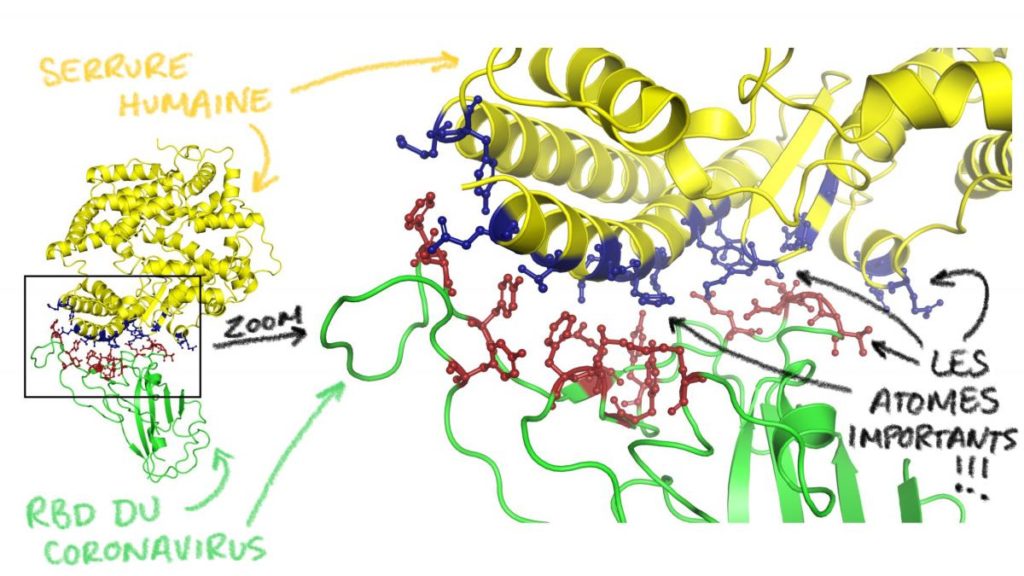
Cette fois-ci, j’ai encore colorié le RBD en vert, mais vous voyez en plus une partie de la serrure humaine, à savoir la protéine ACE2 (en jaune). La section droite de cette photo est un zoom de l’encadré de gauche, montrant des petites boules rouges et bleues, qui sont en fait les atomes importants qui doivent se reconnaître entre eux pour permettre au virus d’entrer dans nos cellules.
Et voilà, parce que ces quelques dizaines d’atomes réussissent à se « parler », le virus réussit à entrer dans nos cellules pour nous infecter. Modifiez un certain nombre de ces atomes et vous n’aurez plus de reconnaissance. C’est d’ailleurs ce qui explique en grande partie pourquoi le coronavirus actuel (le SARS-CoV-2) est plus infectieux que le SARS qui a touché la planète en 2003, même s’ils sont de très proches parents. Le reste des processus moléculaires qui mènent au développement des symptômes de la COVID-19 sont loin d’être jolis, mais ils impliquent également des centaines d’autres protéines.
À ce point-ci, j’imagine que vous me voyez venir, n’est-ce pas ? À quoi ça sert la biologie structurale ? Eh bien, qu’arrive-t-il si je vous coupe la main et que je vous demande ensuite d’ouvrir la poignée de votre voiture (en prenant pour acquis que vous n’êtes pas en train de crier de douleur ou d’appeler la police pour me dénoncer) ? Bon d’accord, je ne suis quand même pas si sadique (!), mais disons que je vous mets une énorme mitaine de motoneige sur la main, dans le genre de celles qui sont tellement grosses qu’elles vous empêchent souvent d’agripper quoique ce soit de délicat ?
Les petits comiques parmi vous me diront qu’ils prendront l’autre main pour ouvrir la porte, mais disons que je vous mets une énorme paire de mitaines dans les mains ? Vous ne pourrez plus agripper votre poignée de voiture pour y entrer. Même chose avec le coronavirus : si on réussit à empêcher ces quelques atomes en rouge de reconnaître les atomes en bleu en mettant une « paire de mitaines » entre les deux, on empêche le virus de reconnaître nos cellules et l’infection au coronavirus ne peut se produire.
C’est l’une des utilités de la biologie structurale : nous permettre de voir ce qui se passe au niveau atomique dans le but de développer de petites molécules spécifiques qui perturberont cette interface unique entre les deux protéines. Le but, c’est d’offrir aux atomes rouges quelque chose qu’ils « aimeront » encore plus « coller » que les atomes bleus. On ne parle pas ici du développement d’un vaccin (qui passe par un tout autre mécanisme moléculaire), mais cette approche est l’une des nombreuses pistes de développement de potentiels médicaments antiviraux visant à prévenir ou à réduire l’effet de l’infection au coronavirus.
J’espère vous avoir convaincu que les protéines, ce n’est pas qu’une question d’alimentation !
Références