- Recherche
Une découverte d’une doctorante de l’INRS éclaire les stratégies de survie d’un parasite redoutable

Ilona Gdovinova, doctorante à l’INRS et le professeur Albert Descoteaux, directeur de l’Infectiôpole, et auteur principal de l’étude. Photo : INRS
La leishmaniose est une maladie parasitaire qui touche jusqu’à 1 million de personnes dans le monde chaque année. Elle est causée par le protozoaire Leishmania qui est transmis par la morsure d’un insecte appelé mouche des sables. Une fois transmis à son hôte (l’humain ou l’animal), le parasite Leishmania s’installe dans des cellules du système immunitaire appelées macrophages, et s’y multiplie à l’intérieur de structures en forme de petites bulles, appelées vacuoles parasitophores.

Pour se répliquer, le parasite Leishmania a besoin de lipides, des molécules essentielles pour de nombreuses fonctions cellulaires. Contrairement à ce que l’on croyait, la forme amastigote du parasite qui se multiplie chez l’humain ne produit pas ses propres lipides. Elle doit donc les puiser directement dans la cellule-hôte.
Cette découverte réalisée par l’équipe du professeur Albert Descoteaux de l’Institut national de la recherche scientifique (INRS) fait l’objet d’une publication récente dans la revue PLoS Pathogens.
Une protéine détournée à des fins parasitaires
Dans le cadre de sa thèse, Ilona Gdovinova, doctorante en virologie et immunologie à l’INRS, a découvert un mécanisme clé par lequel le parasite Leishmania s’approprie une classe de lipides appelée sphingolipides. Elle a montré que le parasite détourne une protéine du macrophage appelée VAPA, normalement responsable du transport de lipides entre les compartiments cellulaires.
En observant des macrophages infectés, l’équipe a constaté que la protéine VAPA s’accumulait autour des vacuoles contenant le parasite. Lorsque cette protéine est bloquée, la vacuole ne peut plus s’agrandir et le parasite cesse de se multiplier.
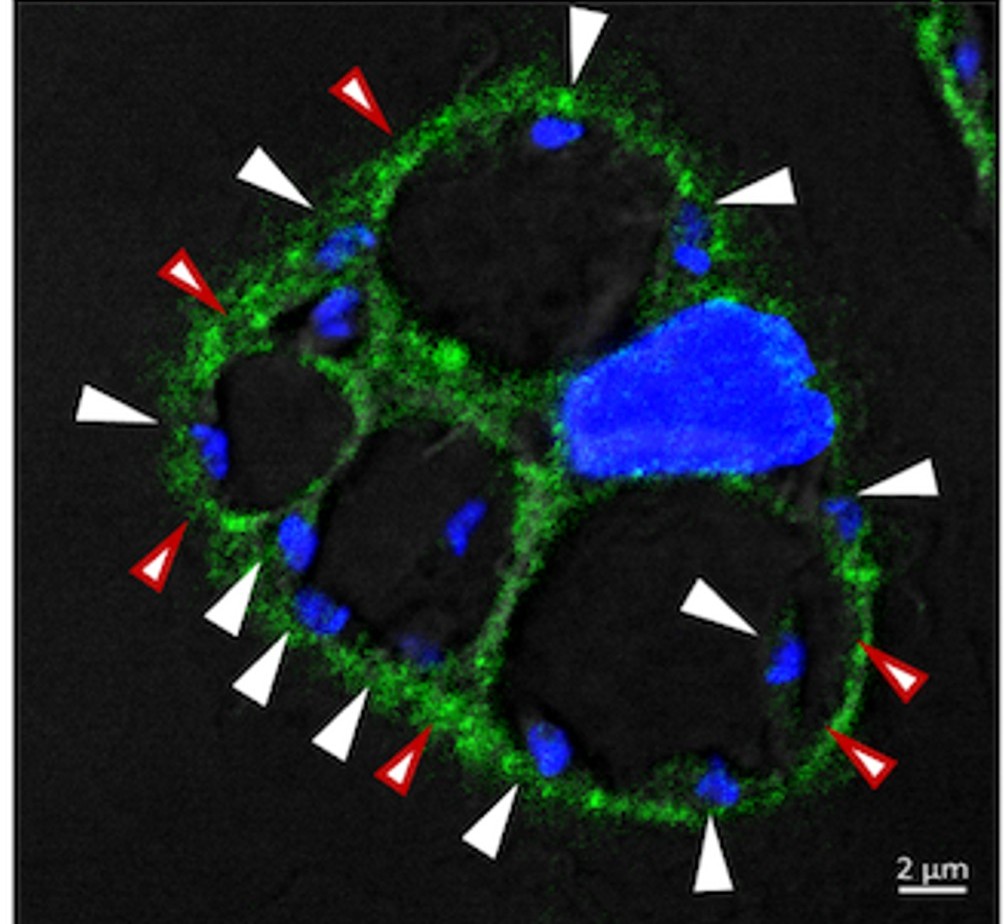
Macrophage infecté par L. amazonensis. La protéine VAPA (en vert) est présente à la membrane de la vacuole parasitophore communale contenant L. amazonensis. Les flèches blanches indiquent les parasites, tandis que les flèches rouges mettent en évidence le recrutement de la protéine VAPA à la vacuole parasitophore.
Crédit : Gdovinova, PLOS Pathogens 2025

« Le parasite utilise la protéine VAPA comme un pont pour faire transiter les lipides dont il a besoin. Il interrompt même ses interactions normales avec d’autres protéines pour mieux l’utiliser à son avantage. Cette découverte illustre à quel point les parasites peuvent manipuler finement les fonctions cellulaires pour assurer leur survie. »
Ilona Gdovinova, doctorante en virologie et immunologie à l’INRS et premier auteur de l’étude.
Les résultats de l’équipe, basée au Centre Armand-Frappier Santé Biotechnologie de l’INRS, montrent aussi que la protéine VAPA aide le parasite à transporter une molécule de virulence importante pour sa capacité à infecter son hôte vers une autre partie de la cellule qu’il attaque. Cela montre que la protéine joue un rôle clé dans les échanges entre le parasite et la cellule, dans les deux sens.

« Ces travaux qui ont permis d’identifier un mécanisme crucial d’acquisition de sphingolipides par le parasite Leishmania, ouvrent la voie à de nouvelles stratégies pour bloquer sa réplication »
Albert Descoteaux, professeur à l’INRS, directeur de l’Infectiôpole, et auteur principal de l’étude.
Le professeur Descoteaux, spécialiste des interactions entre l’hôte et les agents pathogènes intracellulaires et membre du Pasteur Network, souligne l’importance cruciale de mieux comprendre les mécanismes de réplication de ces agents pathogènes chez l’humain. Cette connaissance est essentielle pour développer de nouvelles approches thérapeutiques ou prophylactiques, particulièrement dans un contexte où la résistance aux médicaments se propage et réduit considérablement les options de traitement déjà limitées.

Leishmaniose : Faits saillants
- La leishmaniose est surtout présente en Amérique du Sud, dans le sud de l’Europe, en Afrique, et en Inde;
- Trois formes principales : viscérale (la plus grave), cutanée (la plus fréquente) et muco-cutanée.
- Entre 700 000 et 1 million de nouveaux cas par an. La maladie cause de 20 000 à 30 000 morts (source : Organisation mondiale de la santé)
- La maladie est liée à la pauvreté, la malnutrition, les déplacements de population et un accès limité aux soins.
À propos de l’étude
Gdovinova I, Descoteaux A (2025) VAPA mediates lipid exchange between Leishmania amazonensis and host macrophages. PLoS Pathog 21(3): e1012636. https://doi.org/10.1371/journal.ppat.1012636
Ces travaux ont été possibles grâce au soutien financier des Instituts de recherche en santé du Canada (IRSC).



